Eigen afweer inzetten bij ziekenhuisinfecties
Eigen afweer inzetten bij ziekenhuisinfecties
Ons afweersysteem beschermt ons door middel van antilichamen tegen kwaadwillende bacteriën. Waarom lukt het ons afweersysteem de ene keer wel en de andere keer niet om bacteriën uit te schakelen? Dat zou te maken kunnen hebben met de werking van ons afweersysteem. Hoogleraar medische microbiologie Suzan Rooijakkers onderzoekt dit in de hoop nieuwe immuuntherapieën te ontwikkelen die antibiotica kunnen vervangen. Op 22 februari hield ze haar oratie, die over dit onderwerp ging.
Bacteriën zijn overal om ons heen: in de zee, in de grond en in gebouwen. Maar ook in je eigen lichaam leven heel veel bacteriën. De meeste van die bacteriën zijn heel nuttig en kunnen geen kwaad, maar er zitten ook bacteriën tussen die ons ziek kunnen maken. Je afweersysteem beschermt je eigen lichaam tegen bacteriën die wel kwaad kunnen. Maar als het jouw lichaam niet lukt die bacterie te verslaan, kun je flink ziek worden. Dan heb je medicatie nodig, zoals antibiotica.
Wat als antibiotica niet werken?
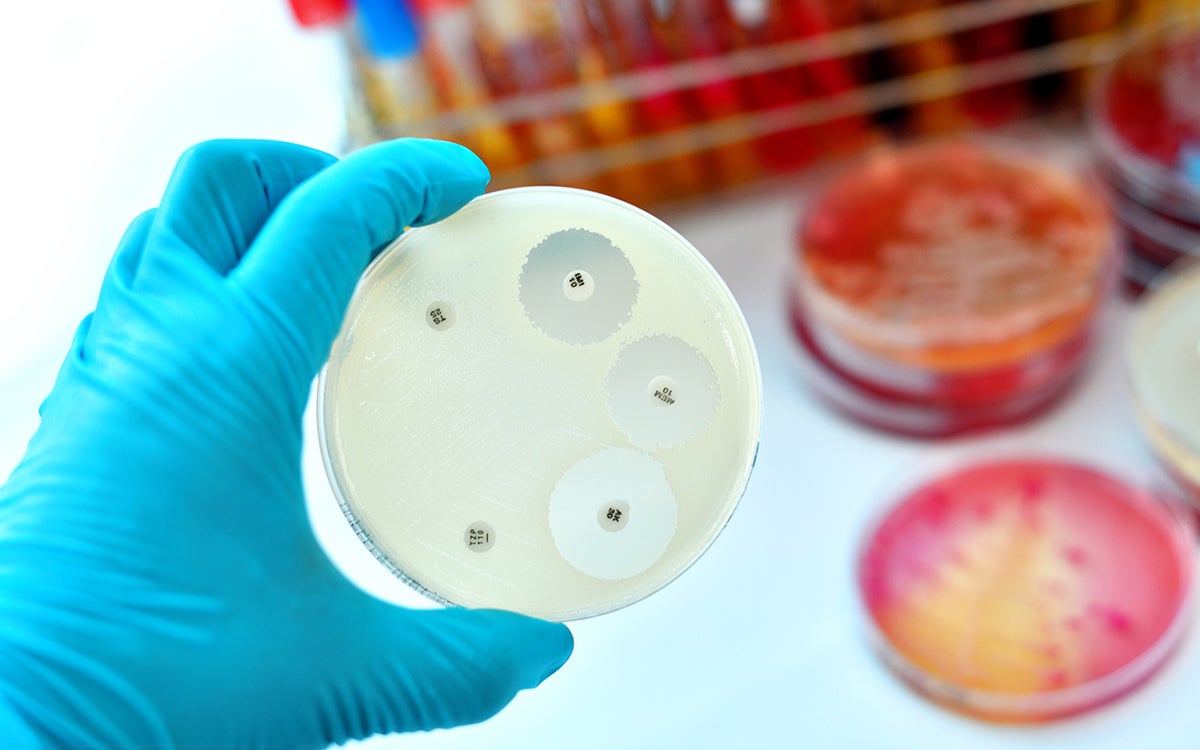
Elk jaar sterven ongeveer 25.000 mensen in Europa door infecties met zogenaamde multiresistente bacteriën. Resistente bacteriën kunnen niet meer verslagen worden door meerdere vormen van antibiotica. Een van de belangrijkste van die multiresistente bacteriën is
Staphylococcus aureus
(beter bekend als MRSA). "De
Staphylococcus aureus
bacterie heeft resistentie tegen verschillende soorten antibiotica ontwikkeld. Er zijn zelfs al vormen die resistent zijn tegen drie antibioticavormen. Dat betekent dat er nauwelijks of geen behandelingsopties meer zijn voor de mensen die hiermee besmet zijn", zegt Suzan in haar oratie. “Bovendien liggen er in ziekenhuizen heel veel patiënten met een verzwakt afweersysteem. Er zijn legio medische behandelingen die het afweersysteem ernstig onderdrukken. Denkt u bijvoorbeeld aan stamceltransplantaties en chemotherapie bij kanker“.
Een logische oplossing lijkt het ontwikkelen van nieuwe antibiotica, waartegen de bacteriën nog geen resistentie hebben opgebouwd. Die ontwikkeling gaat echter moeizaam. Daarom staat de wereld te springen om andere, innovatieve geneesmiddelen tegen infecties. Suzan kijkt vooral naar het immuunsysteem voor ideeën. “Door nieuwe technologische ontwikkelingen liggen er mooie kansen om het afweersysteem beter te maken. Dan kan het afweersysteem van een patiënt verbeterd worden en samen met de antibiotica een infectie veel beter opruimen.”
Antistoffen
In haar onderzoek gaat Suzan samen met Genmab, Prof. Albert Heck en Prof. Piet Gros van de Universiteit Utrecht (UU) onderzoek doen naar de ontwikkeling van therapeutische antilichamen. Antistoffen zijn lichaamseigen eiwitten die aan bacteriën kunnen binden. Een antistof kan niet direct een bacterie doodmaken, maar het helpt andere delen van het afweersysteem bij het opruimen van de bacterie. Die aanval gebeurt met het complementsysteem, een soort chemische reactor van eiwitten die gaten kan maken in een bacterie. Dat doen ze door een soort buisje, een porie, te schieten in de celmembraan om de bacterie te doorboren en uit te schakelen. “Sommige antilichamen zijn van zichzelf heel goed in staat om dat proces uit te voeren en andere niet. Maar allemaal blijken ze de bacterie te herkennen. Er moet dus iets anders zijn dat bepaalt welke antistoffen goed zijn en welke niet. Dat kan bijvoorbeeld liggen aan de precieze plaats waar de antilichamen binden aan de bacteriecel.”
Handje helpen
"De productie van antistoffen door ons eigen lichaam kost veel tijd. Pas 7 dagen na de start van de infectie zijn er antistoffen aangemaakt. Dat duurt te lang voor patiënten in een ziekenhuis. Voor hen komt de antistof reactie veel te laat op gang. Het idee van antistoftherapie is dat we niet gaan zitten wachten totdat de patiënt zelf antistoffen maakt, maar dat we in een vroeg stadium helpen door de infectie te gaan behandelen met therapeutische antistoffen.“
Nieuwe aanknopingspunten
In haar nieuwe onderzoek wil Suzan een dwarsdoorsnede van de betreffende bacteriën gebruiken om de meest nuttige antilichamen te vinden en verder te kweken. “Lang dachten we dat een antistof alleen aan een cel hoeft te binden om het complementsysteem aan te zetten. Nu weten we dat antistoffen iets bijzonders moeten doen om goed complement te activeren, namelijk samen clusteren om complement te binden.” Suzan voorziet dat deze benadering nieuwe aanknopingspunten zal opleveren voor de ontwikkeling van goede antilichamen. “Samen met Genmab hebben we aangetoond dat we de clustering van antistoffen op bacteriën ook kunnen verbeteren met behulp van een gepatenteerde technologie. Deze kennis en technologie gaan we nu inzetten bij de ontwikkeling van therapeutische antistoffen tegen infecties.”
Utrecht Molecular Immunology Hub
Suzan Rooijakkers is co-coördinator van de Utrecht Molecular Immunology Hub. Daar bundelen wetenschappers van de Faculteit Diergeneeskunde, Faculteit Natuurwetenschappen en het UMC Utrecht hun krachten. Zij werken samen om te begrijpen hoe het immuunsysteem werkt en zo bij te dragen aan de ontwikkeling van nieuwe manieren van immuuntherapie. Ook wordt daar intensief samengewerkt met Genmab, een internationaal biotech bedrijf dat innovatieve therapeutische producten op basis van antilichamen ontwikkelt. Meer weten over de Utrecht Molecular Immunology Hub? Bekijk dan het filmpje hieronder:
In deze folder bevindt zich extra informatie door middel van een video. Scan de bovenste QR-code met uw telefoon om deze video te bekijken. Of bekijk de video via:
Lees ook ons eerdere bericht over de status van antibioticaresistentie in Nederland